O que é o Complexo de Golgi?
Na biologia celular, o aparelho de Golgi, complexo de Golgi, retículo, aparelho de Golgi ou complexo de Golgi são as organelas das células eucarióticas. O nome é uma homenagem ao seu descobridor, o italiano Camilo Gorky. Consiste em dobras de membranas e vesículas, e sua principal função é secretar proteínas ribossômicas e sua distribuição nessas vesículas. Como tal, funciona como uma espécie de sistema de distribuição central na célula, servindo como centro de armazenamento, conversão, embalagem e transporte de substâncias.
O complexo de Golgi também é responsável pela formação de lisossomos, lamelas intermediárias da planta e acrossomas de espermatozoides, glicocálice, e está envolvido na síntese de polissacarídeos. Acredita-se também que as organelas sejam responsáveis por alguns processos pós-traducionais, como adicionar sinais às proteínas para direcioná-las aos locais da célula onde funcionarão.
A maioria das vesículas de transporte que saem do RE são transportadas para o aparelho de Golgi, onde são modificadas, ordenadas e enviadas ao seu destino final. Essa organela está presente na maioria das células eucarióticas, mas tende a ser mais proeminente em células de órgãos responsáveis pela secreção de determinadas substâncias, como pâncreas, hipófise e tireoide.
Devido ao seu tamanho relativamente grande, o complexo de Golgi foi uma das primeiras organelas a serem descritas e observadas em detalhes. Essa estrutura foi descoberta em 1898 pelo médico italiano Camilo Gorky enquanto investigava o sistema nervoso. Inicialmente, logo após observar a estrutura ao microscópio, ele a chamou de malha interna.
Pouco depois de anunciar sua descoberta, a organela recebeu seu nome e Camilo Gorky, juntamente com Santiago Ramon Cajal, recebeu o Prêmio Nobel por seu trabalho no estudo e descoberta da estrutura do sistema nervoso. No entanto, algumas dúvidas foram levantadas sobre a primeira descrição, argumentando que a aparência da estrutura é realmente apenas uma ilusão de ótica criada pelas técnicas de observação usadas por Golgi. Com o desenvolvimento dos microscópios modernos, no caso os microscópios eletrônicos, esse achado foi confirmado no século XX, principalmente em 19543,4.
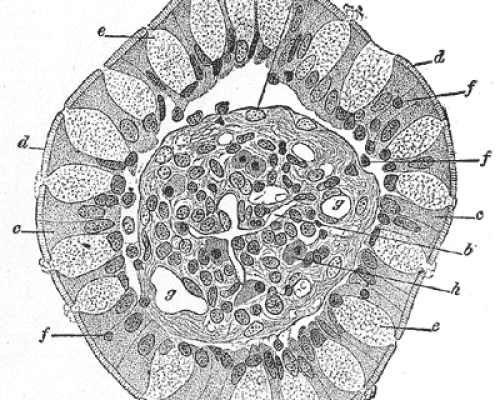
Por ter sido visualizado seletivamente por impregnação de prata, o aparelho de Golgi foi uma das primeiras organelas a serem descritas pelos primeiros microscopistas de luz, sendo Golgi e Cajal os primeiros responsáveis pela descrição dessa organela. Consiste em um conjunto de compartimentos de membrana plana chamados reservatórios, que juntos se assemelham ao formato de uma bateria. Nas células animais, as junções tubulares entre os pools correspondentes conectam muitas células para formar um único complexo que geralmente está localizado próximo ao núcleo e próximo ao centrossomo.
Esta localização depende dos microtúbulos. Se os microtúbulos são despolimerizados experimentalmente, o aparelho de Golgi se reorganiza em pilhas individuais intercaladas por todo o citoplasma adjacente ao local de saída do RE. Quanto maior a demanda para a produção e secreção de compostos celulares e extracelulares, maior o volume do aparelho de Golgi presente na célula, geralmente localizado na região nuclear, como nos hepatócitos, neurônios e células glandulares.
Além do método de impregnação de prata, o complexo de Golgi também pode ser visualizado por microscopia de fluorescência, utilizando uma proteína com propriedades fluorescentes (geralmente um anticorpo) para marcar as proteínas residentes nesta organela, de modo que a localização do complexo de Golgi possa ser determinada quando as células são fixas.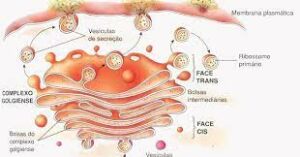
As organelas em questão também podem ser visualizadas por microscopia eletrônica de transmissão, onde se verifica a presença de tanques empilhados, de onde brotam ou se fundem vesículas. As micrografias eletrônicas podem mostrar Golgi não corado, corado com ósmio (preferencialmente para rotular o pool do compartimento cis) ou corado para revelar a localização de enzimas específicas (por exemplo, difosfatase de nucleosídeos, encontrada no pool trans, ou fosfatase, encontrada no compartimento trans ) em toda a rede). Na maioria dos casos, mais de um tanque foi corado no método utilizado para micrografias eletrônicas.
A função do complexo de Golgi
Síntese de Polissacarídeos: Alguns polissacarídeos são sintetizados pelo aparelho de Golgi. Nas plantas, após a mitose, é necessário produzir uma lamela intermediária para que as duas células possam ser separadas. Os flocos são produzidos pela secreção de pectina, que, juntamente com a hemicelulose, é um polissacarídeo sintetizado pelo Golgi. Juntamente com outros componentes, esses polissacarídeos formam as paredes celulares das plantas. Nos animais, a relação entre o aparelho de Golgi e os polissacarídeos ocorre por meio da síntese de glicosaminoglicanos, que atuam como anticoagulantes.
Glicosilação: O Golgi confere a mais forte glicosilação ligada ao O nas proteínas centrais de todas as mucinas, glicoproteínas secretadas por muco e proteoglicanos, onde são modificados para produzir proteoglicanos. Este processo envolve a polimerização de uma ou mais cadeias de glicosaminoglicanos através de ligações xilose na proteína central serina. Muitos proteoglicanos são secretados e se tornam componentes da matriz extracelular, enquanto outros permanecem ancorados à membrana plasmática. Existem também componentes principais que formam substâncias pegajosas, como muco secretado para formar um revestimento protetor em muitas células epiteliais. Logo após a produção desses polímeros, os açúcares incorporados aos glicosaminoglicanos são fortemente sulfatados no aparelho de Golgi, aumentando assim uma porção significativa de sua carga característica principalmente negativa. Alguns resíduos de tirosina de proteínas também são sulfatados logo após deixarem o Golgi.
Formação do acrossoma: O complexo de Golgi desempenha um papel muito importante no processo de fertilização, pois o acrossoma é produzido a partir dele. Os acrossomas são vesículas que aparecem durante as mudanças morfofuncionais na maturação dos espermatozoides. Essa mudança envolve a regulação do aparelho de Golgi nos primeiros dois terços da cabeça do espermatozóide, envolvendo o núcleo. Sua função é permitir a entrada de material genético paterno no oócito secundário por meio de hidrolases localizadas na cabeça do espermatozoide. Quando a membrana acrossômica se funde com a membrana plasmática do espermatozóide, essas enzimas são liberadas na forma de exocitose, formando poros onde as enzimas são liberadas.
Sua estrutura
sistema de membrana intracelular. O complexo de Golgi é representado como dobras de membrana verdes.
O complexo de Golgi consiste em um conjunto de compartimentos achatados definidos por membranas, chamadas de cisternas, que são descontínuas, ou seja, comunicam-se diretamente. Este grupo se assemelha a uma pilha de placas, e cada Golgi geralmente contém 4 a 6 pools, embora alguns flagelados unicelulares possam ter mais de 20. Nas células animais, está localizado próximo ao núcleo e centrossomo. Adjacente ao retículo endoplasmático, entretanto, na maioria das células vegetais, centenas de células individuais estão espalhadas perto do retículo endoplasmático. Essa organização conta com microtúbulos e, no caso de despolimerização, o aparelho de Golgi é disperso em várias pilhas.
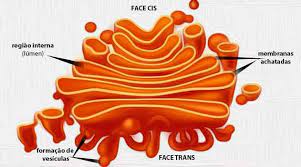
Cada pilha de Golgi tem uma face cis e uma face trans. O lado cis corresponde ao lado de entrada das vesículas reticulares de proteínas e lipídios a serem processados, enquanto o lado trans corresponde ao lado de saída das vesículas que se dirigem à superfície celular ou outros compartimentos. Ambos os lados estão associados a compartimentos constituídos por estruturas tubulares e uma rede de cisternas: a rede cis-Golgi (CGN) e a rede trans-Golgi (TGN). Nessas redes, há uma série de pools que formam uma pilha, cada um com uma composição enzimática diferente e, portanto, uma função diferente. Portanto, o complexo de Golgi geralmente consiste em uma configuração mínima que consiste em:
A rede Golgi cis, ou CGN,
reservatório cis,
piscina interna,
anti-tanque e
Rede Trans-Golgi, ou TGN.
Dentro de cada reservatório estão enzimas que modificam proteínas que chegam ao complexo de Golgi. Assim, ao chegar ao CGN, as proteínas passam primeiro pela rede cis-Golgi e continuam na seguinte ordem: pool cis, pool medial e, finalmente, pool trans. Após deixar o TGN, as proteínas podem progredir e se mover para os lisossomos, vesículas secretoras ou a superfície celular, ou podem retornar ao compartimento anterior. Vale ressaltar, no entanto, que tanto as redes cis quanto as trans desempenham um papel na distribuição de proteínas, pois as proteínas que entram no CGN podem prosseguir no Golgi (fluxo anterógrado) ou retornar ao RE (fluxo retrógrado), se não . Produção adequada.
À medida que se movem de pool em pool através da pilha, as proteínas são continuamente modificadas em cada estágio até que a glicosilação esteja completa. As enzimas localizadas em cada reservatório são diferentes. Por exemplo, na cisterna medial há enzimas que catalisam a remoção de resíduos de manose e a adição de N-acetilglucosamina; na rede trans-reservatório e trans-Golgi, há enzimas que catalisam a adição de galactose e ácido siálico.
Além disso, essas diferentes enzimas são conhecidas por terem diferentes pH ótimos, portanto, cada compartimento do complexo de Golgi tem seu próprio pH , razão pela qual não há conexão direta entre os pools: caso sim Se isso acontecer, o pH de todo o complexo é homogeneizado e várias enzimas são desnaturadas. Essa diferença de pH pode ser explicada pela presença de bombas de prótons ATP-dependentes na membrana do complexo de Golgi, que promovem a acidificação do pool e, conforme observado no estudo, o número de bombas de prótons aumenta gradativamente de cis para trans.
Formação e transporte de vesículas
As vesículas transportadoras se formam a partir de locais específicos na membrana celular, brotando como vesículas revestidas de proteínas. Antes que a vesícula se funda com o alvo, o revestimento se desprende, permitindo que as membranas entrem em contato e se fundam.
As proteínas de revestimento mais estudadas se dividem em três grupos principais: clatrina, COP I e COP II. As vesículas revestidas de clatrina estão mais associadas ao transporte entre o Golgi e a membrana plasmática, e as proteínas COP I e COP II estão mais associadas ao transporte entre o retículo endoplasmático e o complexo de Golgi (vesículas revestidas por COPI do brotamento do corpo de Golgi, COPII- vesículas revestidas brotam do retículo), mas é importante notar que os tipos de vesículas transportadoras não estão limitados a esses exemplos principais.
A clatrina é composta por 3 grandes e 3 pequenas cadeias polipeptídicas ligadas entre si para formar uma estrutura “tripodal” que facilita as interações eletrostáticas com os grupos de cabeça lipídica da membrana por meio de força mecânica e proteínas de dobra de membrana (domínios BAR). ) promove o dobramento da membrana no citosol.
A formação de vesículas mediada por clatrina depende da ação de outra proteína chamada adaptina, uma proteína adaptadora que medeia a ligação entre a clatrina e as vesículas, de modo que a clatrina não entra em contato direto com as vesículas. Nesse caso, as proteínas adaptadoras ajudam a selecionar moléculas de membrana e moléculas solúveis para entrada na vesícula, além de serem específicas para receptores transmembrana (receptores de carga) que capturam moléculas solúveis para serem transportadas na vesícula.
O acoplamento de proteínas adaptadoras às membranas é altamente regulado por suas interações com outras moléculas, como os fosfolipídios que compõem a membrana plasmática.
À medida que as vesículas se formam, as proteínas que regulam a frequência de exportação das vesículas, como a dineína, se organizam no colo do broto. Eles facilitam a liberação de vesículas interferindo na estrutura da bicamada ou usando enzimas que quebram os lipídios, ou ambos. Quando liberadas, as vesículas perdem seu revestimento de clatrina sob a ação da proteína chaperona hsp70, o que facilita a quebra de ATP no processo.
Existem proteínas que auxiliam na montagem de clatrina e revestimentos COPI e COPII, como as proteínas ARF (COPI e clatrina coating assembly) e proteínas Sar1 (COPII coating assembly) que recrutam GTPases de revestimento, também Papel na Desmontagem das Camadas de Revestimento Vesículas revestidas com clatrina e COP perdem seu revestimento após o desprendimento.
É importante enfatizar que os mecanismos pelos quais COP I ou II e clatrina formam vesículas são diferentes. O COP usa a desfosforilação do GTP para se montar na superfície onde as vesículas serão formadas. Nesse caso, a montagem das vesículas pela clatrina pode ser mais vantajosa, pois não requer energia para ocorrer. Outro ponto interessante é que o envelope formado pela clatrina é mais abundante, pois facilita a maior proximidade das moléculas alvo e, além disso, é mais específico que o COP, pois as vesículas são formadas mais rapidamente, impedindo a entrada. corpo estranho..
Durante a brotação, as vesículas são ancoradas a proteínas motoras. Essas proteínas se ligam aos microtúbulos do citoesqueleto para transportar vesículas para seus destinos.
A proteína que direciona o tráfego de vesículas, chamada RAB, é um marcador molecular exposto na saída do envelope proteico que ajuda a identificar cada tipo de membrana, servindo como o “endereço” para o qual as vesículas precisam ser enviadas. Vesículas de transporte e/ou membranas alvo.
Quando uma vesícula atinge seu compartimento de destino, a vesícula carrega uma proteína de captura específica do RAB e, quando se encontram, ocorre um processo de ancoragem.
A fusão das vesículas com a membrana alvo é assegurada pela ação de proteínas filamentosas chamadas SNAREs. Existem dois tipos principais de proteínas SNARE: aquelas presas em vesículas (V snare) e aquelas presas em compartimentos de receptores (T snare). Quando ocorre a ancoragem, as proteínas SNARE nas duas membranas se emparelham e se dobram, catalisando a fusão das duas bicamadas lipídicas. Durante o encaixe e a fusão, uma fosfatase (RAB-GAP) induz a proteína Rab a hidrolisar o GTP de sua estrutura, dissociando-o da membrana e devolvendo-o ao citosol, deixado solúvel e inativo por outra proteína. Após a fusão mediada por SNARE, uma proteína se liga ao complexo SNARE e, com a ajuda de outras proteínas acessórias, ocorre a hidrólise de ATP para dissociar os SNAREs, deixando-os livres para funcionar novamente.
Todos esses mecanismos citados são extremamente importantes para a transmissão dos impulsos nervosos, pois estão envolvidos na liberação do neurotransmissor acetilcolina.
Um fato interessante é que alguns vírus usam um processo mediado por SNARE para se fundir com células como o HIV: ele possui dois tipos principais de armadilhas (T e V) e proteínas que enganam os receptores da membrana celular, como a GP120. Quando acoplado a esse receptor, o vírus inocula um de seus SNARES na membrana plasmática e, ao interagir, aproxima as duas superfícies e promove a fusão, seguida da entrada do capsídeo na célula.
Voltando ao complexo de Golgi, a face Cys é a face que recebe material do retículo endoplasmático, onde ocorrem alterações em algumas proteínas que são glicosiladas (N-glicosilação), aparando no complexo (O-glicosilação). No verso, o material é enviado para todos os endereços das unidades de forma anterógrada. Vários pools de Golgi se comunicam através da formação de vesículas, e cada pool possui seu próprio pH específico para cada tipo de evento.
Há também um movimento retrógrado em que há um sinal químico (geralmente duas lisinas seguidas de mais dois aminoácidos ou a sequência KDEL), que indica que a vesícula deve retornar ao retículo endoplasmático. Neste caso, a Polícia I ajudará no processo.
Existem 3 tipos principais de vesículas que são excretadas através do trans: o primeiro tipo de vesículas move-se imediatamente e se funde com a membrana plasmática, liberando seu conteúdo por exocitose, o segundo tipo de vesículas, chamadas de vesículas secretoras, são armazenadas dentro da terceira. tipos de vesículas apontam para lisossomos, bem como organelas de armazenamento semelhantes a lisossomos em algumas células.
Todos esses processos que ocorrem no Golgi são essenciais porque aumenta os tipos de proteínas glicosiladas, contribui para o processo de formação dos lisossomos e também interage com células produtoras de secreção, como os fibroblastos. ) está relacionado ao efeito.
Outro processo associado ao tráfico de vesículas ligadas ao Golgi envolve processos celulares envolvendo endossomos. Os endossomos são caracterizados como organelas com bombas de hidrogênio, formadas durante algum transporte molecular entre o Golgi e a membrana, e estão associadas à entrada de macromoléculas solúveis e à aquisição de diferentes materiais por células especializadas.
Quando um material é endocitado, estruturas chamadas endossomos primários se formam perto da membrana, que são vesículas que contêm parte da membrana celular e receptores que sinalizaram para proteínas específicas que A região que contribui para a formação das vesículas.
Nesse caso, a entrada pode ser mediada tanto pela clatrina previamente exposta (que se forma na região fluídica da membrana) quanto por outra proteína distribuída nos fosfolipídios da membrana: a caveolina. A caveolina facilita o acesso a uma região mais rígida da membrana chamada LIPID RAFT, onde a presença do colesterol promove um conjunto de moléculas e a consequente “rigidez”.
As depressões promovem a invaginação dessas regiões por força mecânica para formar as depressões.
Após a formação do endossomo primário, a bomba de hidrogênio é ativada, o que promove uma mudança brusca no pH, o que estimula a formação de vesículas que permitem que o receptor retorne à membrana celular. Este endossomo é transportado por proteínas motoras, aproximando-o do complexo de Golgi para formar um endossomo secundário, que se funde com o lisossomo para degradar moléculas que podem ser reutilizadas pela célula, desta forma as moléculas degradadas são direcionadas ao complexo de Golgi para redistribuição e uso.
Micrografia do aparelho de Golgi, consistindo de uma série de anéis semicirculares pretos agrupados perto da base. Numerosas vesículas redondas também podem ser observadas ao redor das organelas.
Alterações corporais causadas pelo mau funcionamento do complexo de Golgi
O comprometimento de etapas específicas do tráfego entre o retículo endoplasmático, o aparelho de Golgi, o sistema endossoma-lisossomal e a membrana plasmática pode ter efeitos dramáticos nas células, e um número crescente de deficiências nos mecanismos moleculares que regulam o tráfego vesicular estão associados a doenças hereditárias relacionadas.
Durante o trânsito pelo aparelho de Golgi, a maioria das proteínas sofre alterações, incluindo alterações nos perfis de glicosilação, sulfatação e fosforilação, que podem contribuir para a doença.
A falha na glicosilação pode levar ao dobramento incorreto
Proteínas, incapacidade de reconhecer células, instabilidade ou falta de variabilidade proteica, problemas de adesão celular e problemas na estrutura da membrana celular, entre outras coisas, tornam o organismo potencialmente mais suscetível à infecção bacteriana. Portanto, vários processos celulares que dependem da estabilidade proteica e da comunicação intracelular e intercelular podem ser afetados. As doenças causadas por falhas na glicosilação variam de músculo a multissistêmico.
O aparelho de Golgi também tem a função de transportar macromoléculas e secretar vesículas. Assim, no caso de disfunção complexa, as organelas que necessitam do Golgi para repor o material perdido ao longo da vida podem ser comprometidas, levando ao colapso ou morte celular.
Recentemente, a expressão alterada de genes associados a certos membros da família Rab, como RAB1, RAB2 e RAB8, bem como a proteína STX5, tem sido associada à doença de Parkinson, um distúrbio neurológico. A expressão alterada dessas proteínas leva à fragmentação do complexo de Golgi. No nível celular, a doença de Parkinson está associada ao acúmulo da proteína pré-sináptica alfa-sinucleína e ao bloqueio do tráfego ER-Golgi.
Algumas outras doenças causadas pela disfunção de Golgi são a doença de Wilson (ou degeneração hepatolenticular), na qual mutações genéticas fazem com que as proteínas permaneçam no aparelho, a distrofia muscular de Duchenne e a síndrome de Aarskog, na qual há redução do tráfego de Golgi.
A biogênese lisossomal e a síntese acrossômica dos espermatozoides também são de responsabilidade do complexo de Golgi. Assim, defeitos nesta organela também podem estar associados a problemas reprodutivos e deficiências de lisossomo.
Essa deficiência pode ter consequências graves, como suscetibilidade a doenças, deformidades, morte celular ou falência de órgãos. Vale lembrar que, no sistema nervoso central, a secreção, o processamento e o transporte vesicular de moléculas ocorrem o tempo todo. Consequentemente, as sinapses neuronais que dependem desses mecanismos são altamente comprometidas.