O que é a Nitroglicerina?
A nitroglicerina, também conhecida como trinitroglicerina ou trinitrato de glicerol, é um composto explosivo obtido pela nitração do glicerol, sendo seu simbolo comumente conhecido como TNT.
A fórmula química da nitroglicerina é C3H5N3O9 (3 átomos de carbono, 5 átomos de hidrogênio, 9 átomos de oxigênio e 3 átomos de nitrogênio).
Em condições ambientais, é um líquido oleoso com aparência de glicerina bruta, coloração amarela e densidade maior que a da água. Solidifica a 13,3°C.
Sua história
Foi descoberto em 1847 por Ascanio Sobrero (1812-1888), que primeiro o chamou de “piroglicerol”, uma mistura de glicerol, ácido sulfúrico e ácido nítrico.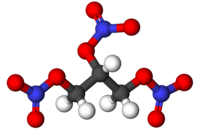
Em 1867, o pai de Alfred Nobel, um engenheiro, instalou uma fábrica de nitroglicerina na cidade russa de St., em particular a terra diatomácea (Kieselguhr[2]) obtida como substância moldável. Tal qualidade foi concedida a patente para explosivos.
Na produção industrial
O ácido nítrico e o ácido sulfúrico são filtrados em um filtro de placas e transferidos do tanque para um reator chamado nitrificador (formando a chamada mistura de ácido sulfínico). O glicerol aquecido e filtrado é enviado ao nitrificador a partir de um tanque com pressão controlada (1,5 atm) e temperatura em torno de 40°C, para que não haja alteração na viscosidade. Para a mistura de ácido sulfínico, considere os mesmos valores de temperatura e pressão. A reação foi completada entre 60 e 90 min a uma temperatura de cerca de 40°C, mantida por um sistema de resfriamento com trocador de calor interno e pressão de 1,5 atm. A nitroglicerina é descarregada e enviada para o primeiro separador orgânico, onde o ácido residual é separado e reaproveitado no processo, assim como a nitroglicerina bruta. Do separador orgânico, a nitroglicerina bruta é enviada para uma série de colunas de lavagem equipadas com anéis de vidro Raschig.
Essas colunas são projetadas para remover o ácido residual ainda presente na mistura de reação. Na primeira coluna, lave com água fria, envie imediatamente para a segunda coluna, onde é colocada uma solução de carbonato de sódio a 3% quente e, finalmente, na última coluna, a nitroglicerina é lavada com água fria. Na parte inferior e superior dessas colunas, ocorre a separação entre a fase aquosa, que é enviada para os tanques de carbonato e solução orgânica. A nitroglicerina retirada do topo da última coluna é filtrada e imediatamente enviada para um separador orgânico tipo “labirinto”, onde é removida em alta pureza (97-99%) livre de resíduos de ácido e água. A fase aquosa retirada da última coluna é enviada para outro separador orgânico, também do tipo “labirinto”, para recuperar a nitroglicerina restante.
Em medicina
Também é usado na medicina, como vasodilatador, no tratamento de doenças cardíacas, no tratamento de doenças isquêmicas da artéria coronária, infarto agudo do miocárdio e insuficiência cardíaca congestiva. É administrado por via transdérmica, sublingual ou intravenosa. Pertence ao grupo de medicamentos antianginosos.
Quase todas as drogas atualmente usadas para dilatar as artérias coronárias são derivadas da nitroglicerina.
O mecanismo de ação da nitroglicerina em cardiopatas foi descoberto por cientistas americanos (Robert Furchgott, Louis Ignarro e Ferid Murad, que ganhou o Prêmio Nobel por essa descoberta) e está relacionado às células, às mitocôndrias e ao mecanismo energético das células. Enzima que libera óxido nítrico (NO). Quando a nitroglicerina se transforma em óxido nítrico, faz com que os músculos relaxem, o que alarga as artérias.
Deve-se notar que Ascanio Sobrero (sintetizado por ele em 1847) observou que essa substância causa dores de cabeça, que são causadas justamente pela dilatação dos vasos sanguíneos cranianos. Mas foi Murrel em 1879 quem primeiro descreveu os benefícios da nitroglicerina para doenças cardíacas.
Foi originalmente usado em pequenas doses, especialmente na medicina nos Estados Unidos, sob o nome de glonoína, em uma solução a 1% em álcool, para combater a neuralgia cardíaca, distúrbios nervosos, enxaquecas, soluços e náuseas.
A nitroglicerina foi usada por alguns ciclistas franceses por seu efeito vasodilatador coronário durante uma corrida de ciclismo de seis dias na França em 1879.
Em 1886, durante a corrida de 600 quilômetros entre Bordeaux e Paris, ocorreu a primeira morte possível por doping: o ciclista britânico Linton morreu por usar uma mistura de cocaína e nitroglicerina.
Como explosivos e propelentes
Por tonelagem, o principal uso da nitroglicerina é para explosivos e propulsores, como explosivos, e é um ingrediente em várias formulações de pólvora sem fumaça.
Seu uso como propulsor começou com o desenvolvimento de mísseis balísticos pela Nobel, patenteado em 1887 pela combinação de nitroglicerina com nitrocelulose, o único ingrediente em propulsores de munições até então, e passou a ser utilizado por diversos países ao redor do mundo. Dois anos depois, Sir Frederick Abel e Sir James Dewar, a mando dos governos do Reino Unido e da Commonwealth, desenvolveram uma variante da fórmula do Nobel composta por 58% de nitroglicerina, 37% de nitrocelulose vegetariana e 5,0% de vaselina, conhecida como “cordite”. Desde então, diferentes versões do produto foram criadas, e o uso de nitroglicerina em propelentes de munição tornou-se comum.
Como subprodutos como explosivos são fáceis de produzir e baratos, eles são amplamente utilizados em tarefas de engenharia civil, como perfuração de túneis rodoviários e ferroviários, mineração, limpeza de terras agrícolas, pedreiras e trabalhos de demolição. Da mesma forma, os engenheiros militares usam explosivos para trabalhos de construção e demolição.
No entanto, sua sensibilidade limitou o uso da nitroglicerina como explosivo militar e civil e foi substituída por explosivos menos sensíveis, como TNT, RDX e HMX.
Quando detonado, ele se decompõe de acordo com a seguinte equação:
4 C3H5N3O9 (l) → 10 H2O (g) + 6 N2 (g) + 12 CO (g) + 7 O2 (g)
A adição de oxigênio ao pó sem fumaça através da decomposição do composto é vantajosa, pois permite um melhor equilíbrio oxidativo da mistura, resultando na combustão de compostos residuais durante a deflagração combinada.